兼具多孔性和结晶性的共价有机框架 (COFs) 材料以其构筑单元和功能的多样化和可设计性而得到广泛研究。[1] 对于COFs 结构方面的研究思路主要集中在框架的拓扑结构设计和孔道的表面工程修饰,以此为出发点,具有各式各样孔径尺寸和孔道形状的COFs已被陆续报道出来。[2,3] 自 2014 年赵新等首次报道了微孔和介孔周期性有序分布的异孔 COF 以来,这些异孔 COFs 表现出一些有趣的特性。[4] 例如,Ma 等人证明,在酶宿主催化的有机反应中,双孔 COFs 比单孔 COFs 更有利。[5]多种尺寸孔隙的共存可以有效地减少扩散障碍。值得注意的是,对于这些目前已报道的 COFs ,包括同时含有多种孔道结构的异孔 COFs ,同一材料中其孔道的化学环境大都是相同的。 基于COF在可设计性方面的优势,我们设计并合成了对位分别为亲水性链和疏水性链的不对称的醛基单体,将其与5,10,15,20-四(4-氨基苯基)卟啉反应,制备了一种亚胺连接的COF (DEG-HEP-COF)。同时,构建了只含亲水性链(DEG-COF)或疏水性链(HEP-COF)的COFs作为对照样品。此外,为了研究孔隙分布均匀性对材料性能的影响,采用多组分策略制备了另一种对照样品DEG+HEP-COF,该材料具有随机分布的亲水性和疏水性多孔通道。随后,对DEG-HEP-COF及对照材料的结构性质进行了详细的研究,证明DEG-HEP-COF的优势并不是DEG-COF与HEP-COF的直接线性叠加,也明显有别于具有随机分布的亲/疏水性孔道的DEG+HEP-COF,更可能倾向于具有有序排布的异环境孔道结构(排列方式类似于国际象棋棋盘)。
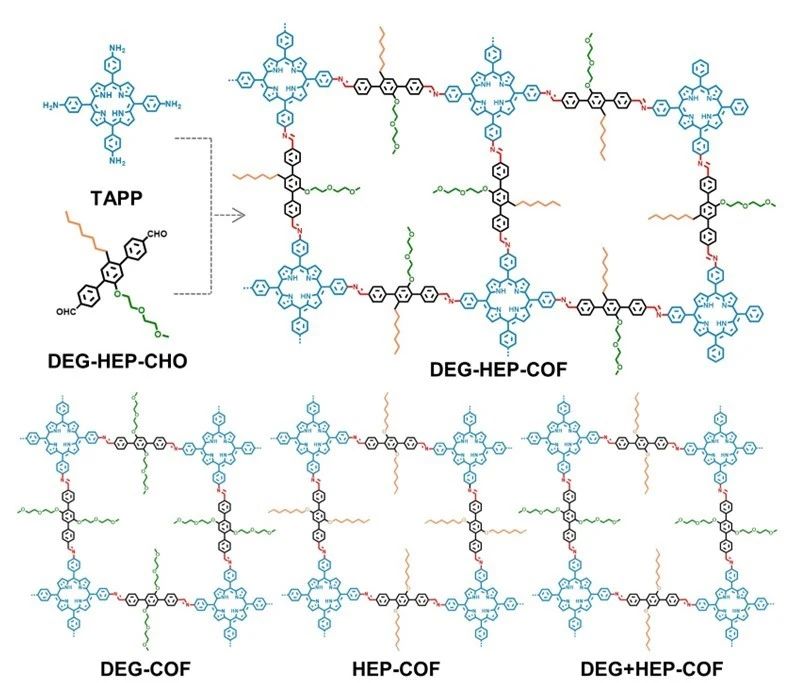
图1. 合成DEG-HEP-COF的示意图,以及对比材料DEG-COF、HEP-COF和DEG+HEP-COF的结构。
用氮气吸附–脱附等温线来分析这些COFs的孔隙率。如图2a所示,DEG-HEP-COF的吸附曲线为典型的I型等温线,BET比表面积为1030 m2 g-1。在P/P0 = 0.97的单点吸附条件下,DEG-HEP-COF的总孔体积为0.49 cm3 g-1。通过非局域密度泛函理论计算,孔隙大小为1.4 nm,表明其属于微孔材料。用PXRD测试表征了COFs的结晶度。如图2b所示,DEG-HEP-COF展现出了尖锐的衍射峰,利用Materials Studio模拟了DEG-HEP-COF的晶体结构,如图2c所示,DEG-HEP-COF采用扭曲的AA堆积模式,模拟结果与实验PXRD数据匹配较好。高分辨率透射电镜(HR-TEM)图像显示出高度有序的晶格条纹,证实了DEG-HEP-COF的周期性有序孔隙结构 (图2d)。
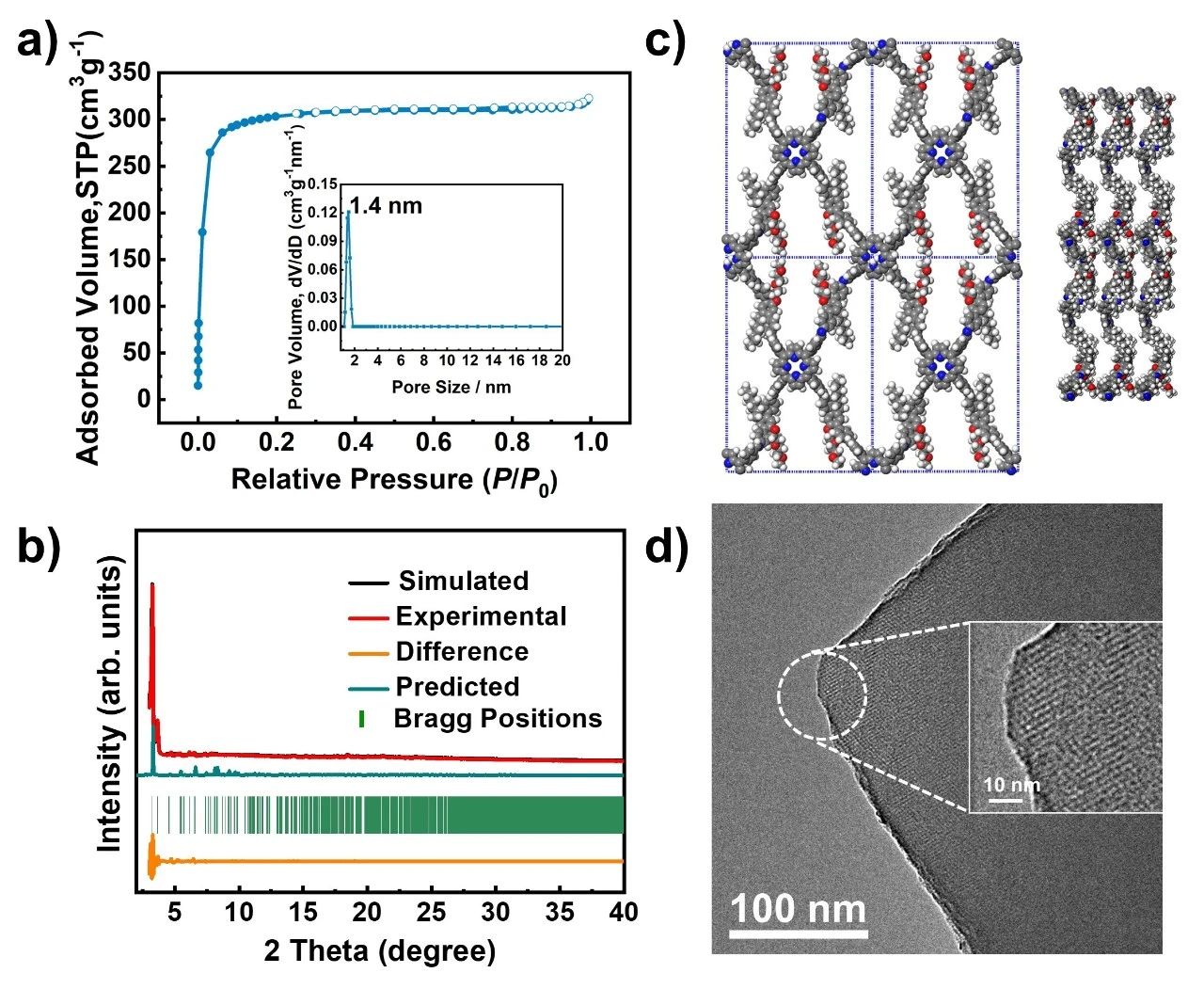
图2. (a) DEG-HEP-COF的氮气吸附–脱附等温线和孔径分布曲线(插图)。(b) 使用扭曲AA堆积模式模拟DEG-HEP-COF的PXRD测试结果。(c) DEG-HEP-COF扭曲重叠(AA)结构的侧视图和俯视图。(d) DEG-HEP-COF的HR-TEM图像。
利用PXRD、氮气吸附–脱附等温线和FE-SEM等测试手段,对本研究中的COFs的结晶度、孔隙度和形貌变化进行了对比分析。DEG-HEP-COF与其他对照COFs生长过程的明显差异源于其结构差异 (图3)。此外,采用原子分辨率扫描隧道显微镜(STM)对两个侧链基团的排列进行了初步研究。如图3d所示,在STM结果中,我们可以确定TAPP的位置和表面DEG-HEP-COF的结构。但由于仪器分辨率和技术特点,我们无法直接观察到DEG-HEP-COF的侧链排列。为此,我们进行了理论计算,进一步探索DEG-HEP-COF的结构合理性。
我们首先计算了COFs片段中的DEG/HEP链的层间相互作用能。在这三种样品中,DEG-COF片段具有最强的相互作用能,而HEP-COF片段的相互作用能是三个样品中最弱的,从结构上分析,含有一半烷基链的DEG-HEP-COF的结晶度可能在一定程度上减弱。然而,具有良好结晶度的DEG-HEP-COF表明,DEG链的相互作用仍然存在于DEG-HEP-COF中,并能促进结晶过程,烷基链的存在调节了结晶速率和孔隙模式,从而提高了结晶度。此外,由烷氧链和烷基链组成的随机孔道环境的DEG+HEP-COF表现出弱的结晶性,进一步证明了DEG-HEP-COF的结构不同于侧链随机分布的DEG+HEP-COF的无序结构。上述现象和计算表明,DEG-HEP-COF中异环境孔道的排列可能是含疏水烷基链孔道和含亲水烷氧链孔道的交替排列。
随后,我们进一步通过DFTB+方法计算了具有不同链取向和不同堆叠结构的DEG-HEP-COF的总能量。对于DEG-HEP-COF,所有烷基链或烷氧基排列在同一孔隙中的相对总能量(RTE)最低,表明它是所有可能情况中相对最稳定的结构 (图3e)。对于层间堆叠结构,计算结果表明,DEG-HEP-COF的层间亲水链(或疏水链)堆叠的AA模式比层间亲疏水链交替堆叠的AA模式能量更稳定,这表明仅用烷基链或烷氧基链堆叠构建的一维通道具有明显的能量偏好。同时,进一步计算了具有轻微滑移结构的重叠AA堆叠模式的能量,结果表明滑移模式的RTE相对于全重叠模式不利。综上一系列计算结果证明了DEG-HEP-COF具有交替孔隙结构的合理性。
我们同时设计并合成了单侧链(疏水烷基链或亲水性环氧乙烷链)的双醛单体,以构建相应的sCOF。孔径分布数据可以推断侧链的排列,从而进一步间接验证DEG-HEP-COF的结构。基于以上多种方式的分析,本研究提出的DEG-HEP-COF中交替孔隙结构是合理的。
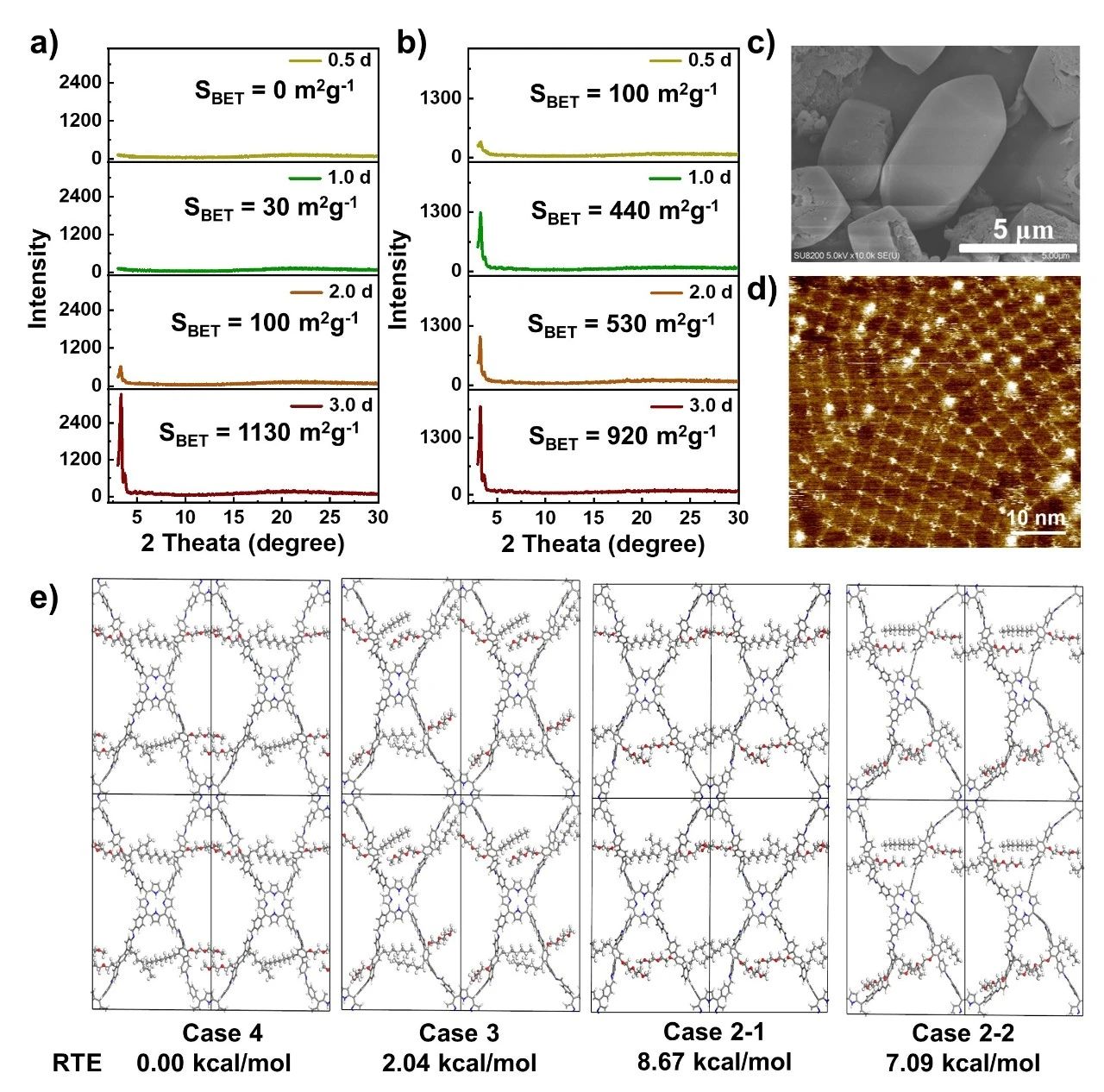
图3. (a) 不同反应时间下DEG-HEP-COF的BET比表面积值和PXRD谱图。(b) 不同反应时间下DEG-COF的BET比表面积值和PXRD谱图。(c) 第14天记录的DEG-HEP-COF的SEM图像。(d) DEG-HEP-COF的STM图像。(e) DEG-HEP-COF层间亲水链(或疏水链)堆叠和层间亲疏水链交替堆叠的AA模式的相对晶体堆叠能(RSE),这两种模式分别包含相邻层完全相同和相反的孔隙结构。
考虑到DEG-HEP-COF独特的异环境多孔道结构,我们推测它可能是一种理想的双抗生素递送载体。与单一抗生素递送相比,这种双抗生素递送策略可以扩大抗菌范围,延迟或减少耐药性的产生。因此,本研究将制备的COFs (DEG-HEP-COF及对照材料)分别负载疏水性左氧氟沙星(Lev)和亲水性万古霉素(Van)抗生素,探讨孔道环境与抗生素负载和释放的关系。实验结果表明具有异环境多孔结构的DEG-HEP-COF是亲疏水药物共递送的理想材料。值得注意的是,DEG-HEP-COF及对照材料对抗生素的负载和释放结果同时间接证明了所提出的异环境孔道交替排列的合理性。
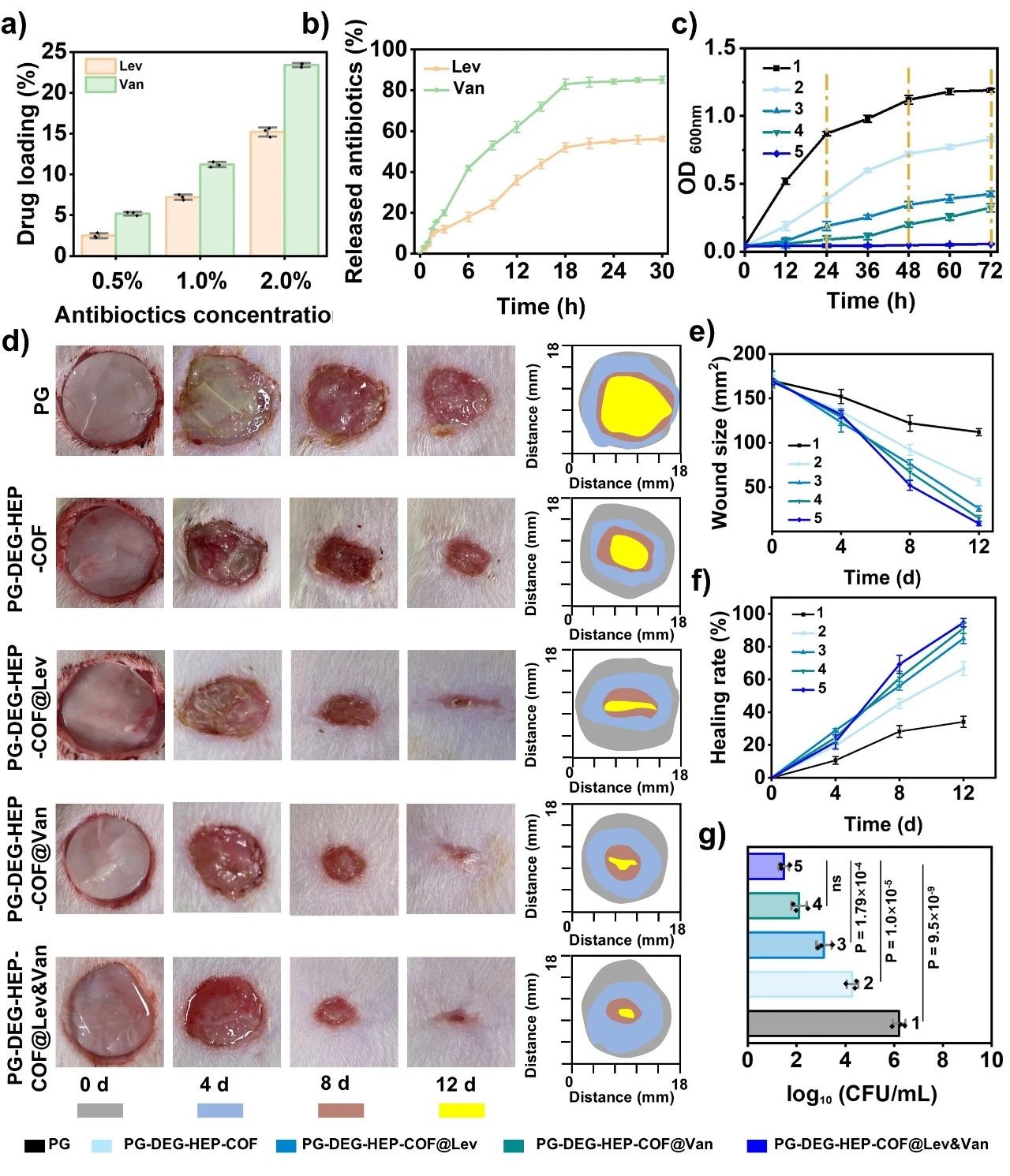
图4. (a) DEG-HEP-COF的抗生素负载率。(b) DEG-HEP-COF的抗生素释放率。(c) 用生长曲线法评价含/不含DEG-HEP-COF@Antibiotics的电纺丝膜在12、24、36、48、60、72 h对MRSA的抗菌效果。(d) 不同组在0、4、8、12 d时伤口愈合的代表性图片(左)和痕迹(右)。(e) 不同组在治疗过程中的伤口大小。(f) 不同治疗组伤口愈合率。(g) 12 d各组创面残余细菌菌落计数(图c、e、f和g中的1、2、3、4、5分别代表PG、PG-DEG-HEP-COF、PG-DEG-HEP-COF@Lev、PG-DEG-HEP-COF@Van、PG-DEG-HEP-COF@Lev&Van膜)。
我们进一步研究了DEG-HEP-COF负载双抗生素体系的体外抗菌效果和体内伤口敷料的抗菌效果(图5)。综上所述,具有异环境孔道的独特COF为亲疏水抗生素的加载提供了理想的环境,从而实现了协同抗菌作用,促进了伤口愈合。此外,DEG-HEP-COF的独特结构使其在抗肿瘤药物联合治疗、精准治疗和个性化治疗等领域有应用潜力和研究价值。
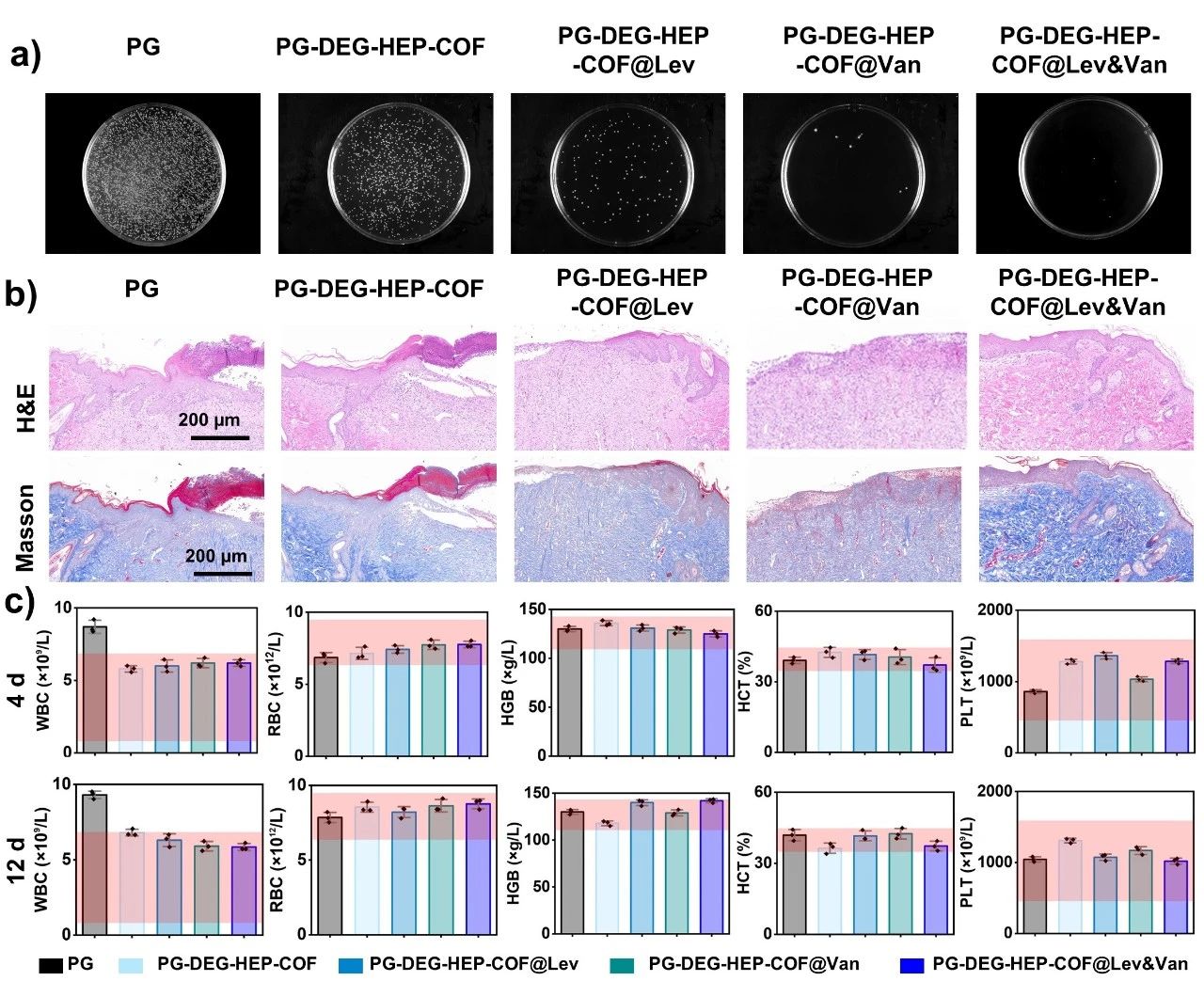
图5. (a) 12 d时不同材料处理伤口分离的琼脂培养皿上残留的细菌菌落。(b) 12 d时不同处理伤口的H&E和Masson染色切片。(c) 第4、12 d血常规指标。
本研究设计了具有不同侧链的不对称醛基单体,制备了具有异环境孔道的DEG-HEP-COF,并系统地表征和探索了DGE-HEP-COF的化学结构和生长过程,此外,DEG-HEP-COF可同时负载疏水和亲水抗生素用于伤口愈合。该研究制备的含异环境孔道的COF不仅极大地扩展了COF材料孔道环境的多样性,展现了孔环境对层叠模式和结晶度的显著影响,也为COF的功能拓展提供了新途径。相关成果以“Synthesis of a Covalent Organic Framework with Hetero-environmental Pores and its Medicine Co-delivery Application”为题发表在Nature Communications上,DOI: 10.1038/s41467-023-41622-x。韩宝航研究员、雷圣宾教授、丁雪松副研究员和查瑞涛副研究员为本文共同通讯作者,国家纳米科学中心与天津大学联合培养研究生籍文艳、国家纳米科学中心张湃博士和天津大学冯光原博士为论文共同第一作者。该研究工作得到了中国科学院战略性先导科技专项B类和国家自然科学基金项目的资助。
文献:
[1] Côté, A. P.; Benin, A. I.; Ockwig, N. W.; O’Keeffe, M.; Matzger, A. J.; Yaghi, O. M. Porous, Crystalline, Covalent Organic Frameworks. Science 2005, 310 (5751), 1166–1170. DOI: 10.1126/science.1120411
[2] Liang, R.-R.; Jiang, S.-Y.; A, R.-H.; Zhao, X. Two-dimensional Covalent Organic Frameworks with Hierarchical Porosity. Chem. Soc. Rev. 2020, 49 (12), 3920–3951. DOI: 10.1039/d0cs00049c
[3] Yusran, Y.; Guan, X.; Li, H.; Fang, Q.; Qiu, S. Postsynthetic Functionalization of Covalent Organic Frameworks.Natl. Sci. Rev. 2020, 7 (1), 170–190. DOI: 10.1093/nsr/nwz122
[4] Zhou, T.-Y.; Xu, S.-Q.; Wen, Q.; Pang, Z.-F.; Zhao, X. One-step Construction of Two Different Kinds of Pores in a 2D Covalent Organic Framework. J. Am. Chem. Soc. 2014, 136 (45), 15885–15888. DOI: 10.1021/ja5092936
[5] Sun, Q.; Aguila, B.; Lan, P. C.; Ma, S. Tuning Pore Heterogeneity in Covalent Organic Frameworks for Enhanced Enzyme Accessibility and Resistance against Denaturants. Adv. Mater. 2019, 31 (19), 1900008(1–7). DOI: 10.1002/adma.201900008
DOI: 10.1038/s41467-023-41622-x
原文链接: https://www.nature.com/articles/s41467-023-41622-x